Miciński P,1 Wielgus E,2 Pawlicki K.2
1 Novomedica, Infertility Clinic, Myslowice, Poland
2,3 II Department of Histology and Embriology, Silesian Medical University, Katowice,
Poland
Adress for correspondence:
Wielgus Ewa
II Department of Histology and Embriology, Silesian Medical University
Medyków 18, 40-752 Katowice-Ligota, Poland
Phone: 48 32 252-65-74
Streszczenie
Cel: Celem pracy było zbadanie wpływu dysfunkcji tarczycy na poziomy w surowicy FSH, LH, i estradiolu w 3 dniu cyklu.
Materiał i metody: Grupa pacjentek w stanie dysfunkcji tarczycy, które zostały zakwalifikowane do badania na podstawie kwestionariusza i podzielone na dwie grupy na podstawie stężenia estradiolu w 3 dniu cyklu. Pacjentki zostały poddane leczeniu dawką tyroksyny: 25-50 mikrogramów. W 3 kolejnym cyklu miesiączkowym oceniono ponownie stan kliniczny pacjentek i dane hormonalne.
Wyniki: Po dwu miesiącach przyjmowania tyroksyny poziomy estradiolu w I grupie pacjentek obniżyły się do normalnych wartości ( 54,0 +- 17,0, p< 0,0003 Wystąpiły też znamienne różnice w poziomach prolaktyny, p< 0,05. W drugiej grupie nie obserwowano znamiennych zmian w poziomach FSH,LH i estradiolu. U 91% wszystkich pacjentek zaobserwowano wyraźne zmniejszenie objawów dysfunkcji tarczycy; zmniejszyło się bolesne miesiączkowanie i ból piersi. W grupie I nastąpiło wyraźne zmniejszenie ilości krwi w czasie miesiączki.
Wnioski: Terapia minimalnymi dawkami tyroksyny normalizuje wydzielanie estradiolu w czasie dwu kolejnych cykli miesiączkowych i odtwarza normalne procesy rekrutacji w jajnikach. Podwyższanie FSH w stosunku do LH reprezentuje wzmożony proces rekrutacji i atrezji rozwijających się pęcherzyków w poprzednich cyklach i poprzez to zmniejszoną rezerwę jajnika.
Wstęp
Tarczyca kontroluje metabolizm narządów i tkanek a stan jej niedoczynności prowadzi do rozległych objawów i stanowi najpowszechniejszy problem endokrynologiczny. Objawy dysfunkcji tarczycy są często niespecyficzne i objawiają się min. przyrostem wagi ciała, obniżeniem nastroju i zmęczeniem. Część z pacjentek prezentuje niekiedy pełny obraz
hypotyreozy, włączając w to takie objawy jak:suchość skóry, wypadanie włosów oraz nadmierne krwawienia miesiączkowe. Kobiety z tego typu stopniem dysfunkcji tarczycy najczęściej są rozczarowane i nie wierzą, iż może mieć miejsce niedoczynnośc tego narządu przy równocześnie prawidłowych poziomach T3 i T4. Taki pogląd często towarzyszy
lekarzowi praktykowi. Podanie małych dawek tyroksyny nieznacznie zwiększa poziom FT4 a w konsekwencji prowadzi do hamowania wydzielania TSH w granicach normy. W efekcie wiele pacjentek uzyskuje subiektywną poprawę ogólnego stanu, co może jednak sugerować najłagodniejszą formę niedoczynności tarczycy związaną z indywidualnym
zapotrzebowaniem na FT4.
Chociaż poziom TSH w surowicy jest prawidłowy, pacjentki klinicznie mogą prezentować cechy hypothyreozy. Pacjentki z eutyreozą na podstawie TSH mogą prezentować 12,1 wszystkich objawów niedoczynności tarczycy (1). Hormony przysadkowe jak TSH, prolaktyna, hormon wzrostu mogą działać synergistycznie z FSH i LH dla spowodowania
przejścia pęcherzyków spoczynkowych w fazę wzrostu.
W czasie normalnego cyklu miesiączkowego ma miejsce rekrutacja kohortu wzrastających pęcherzyków. W czasie fazy folikularnej cyklu miesiączkowego, FSH stymuluje wzrost pęcherzyka, aktywności aromatazy w komórkach ziarnistych, indukcje receptorów LH na błonie komórek ziarnistych i wydzielanie estradiolu. Jako skutek negatywnego sprzężenia estradiolu na przysadkę osoczowe stężenie FSH obniża się. Mimo obniżenia stężenia FSH, dojrzewający pęcherzyk kontynuuje rozwój do stadium przedowulacyjnego. Wzrastanie pęcherzyka prowadzi do wzrostu w surowicy estradiolu i inhibiny, które następowo powoduje obniżenie poziomu FSH.. Niskie poziomy FSH uwrażliwiają jajniki na działanie gonadotropin. Czynność tarczycy ma zasadnicze znaczenie w powstawaniu receptorów LH/HCG w jajnikach. U zwierząt z niedoczynnością tarczycy ilość tych receptorów jest wyraźnie zwiększona (2).
Ocena rezerwy jajnika stanowi ważne pole badań klinicznych, dostarczając informacji o zasobie i funkcjonalnej aktywności pęcherzyków jajnikowych a wiec potencjale reprodukcyjnym kobiety. Podstawowe i dynamiczne testy przewidujące jajnikową rezerwę są szczególnie istotne w stosunku do pacjentek objętych programem wspomaganego rozrodu i
stymulacja jajników.
Cel pracy
Celem pracy było zbadanie wpływu stanu dysfunkcji tarczycy na poziomy w surowicy FSH,LH, estradiolu i prolaktyny w 3 dniu cyklu.
Pacjentki i metody
Zbadano 97 pacjentek w wieku od 28-31 roku życia (śr. 29.5) przygotowywanych do zapłodnienia pozaustrojowego.
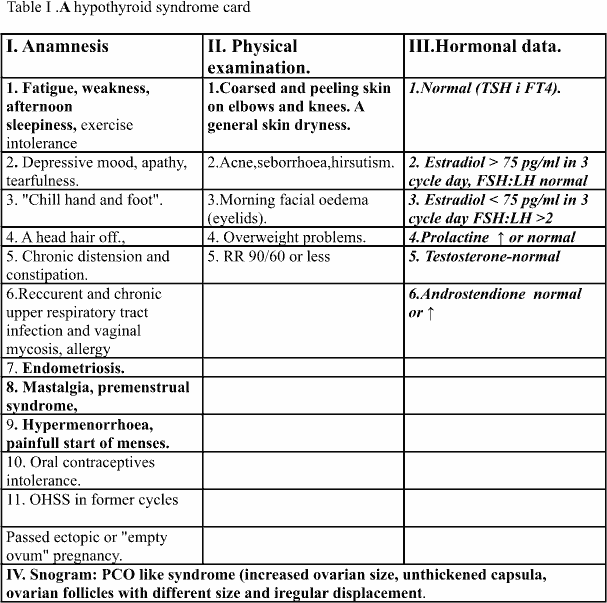
Doboru pacjentek dokonano w oparciu o kliniczny obraz hypotyreozy na podstawie karty tarczycowej (Tab I) oraz przyjęte powszechnie i stosowane standardowo kryteria kliniczne i biochemiczne. U wszystkich pacjentek oznaczono w surowicy aktualne poziomy FT3 i FT4 oraz TSH. Pacjentki podzielono na dwie grupy: pierwszą stanowiły kobiety, u których poziom estradiolu w trzecim dniu cyklu przekraczał 75 pg/ml, drugą pacjentki, u których poziom tego hormonu w analogicznym dniu cyklu utrzymywał się na poziomie poniżej 75 pg/ml. Obu grupom kobiet przez okres 2 miesięcy podawano 25 – 50 ug L-tyroksynę (Berlin-Chemie). Po upływie tego czasu przeprowadzono ponownie analizę stanu klinicznego pacjentek obu grup oraz wykonano oznaczenie poziomów estradiolu, FSH, LH i prolaktyny. Dla statystycznych obliczeń stosowano nieparametryczny test ANOVA. Wyniki przedstawiano jako wartości średnie z odchyleniem standardowym SD. Wartość p niższą niż 0,05 uważano za statystycznie znamienną.
Wyniki
Wszystkie 97 badanych pacjentek przedstawiały objawy niedoczynności tarczycy, mimo prawidłowego poziomu TSH i poziomów wolnej tyroksyny (tab). Analiza przedstawia się następująco.
Grupa I:
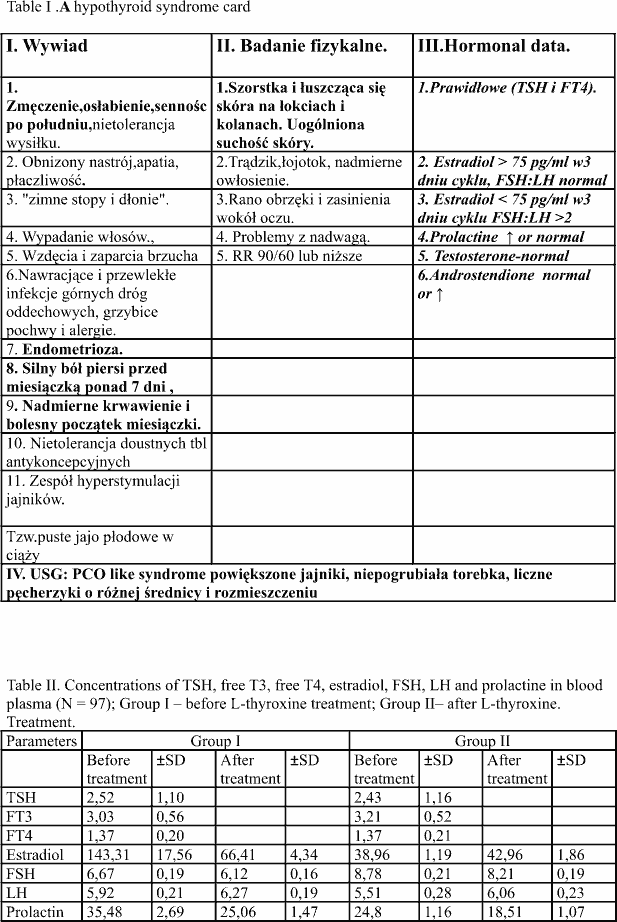
Średnia wartość estradiolu w tej grupie pacjentek utrzymywała się na poziomie 143.3 pg/ml i była wysoce znamiennie statystycznie wyższa w stosunku do pacjentek grupy II-giej (p<0.005). Podanie zastosowanej dawki l-tyroksyny istotnie znamiennie (p<0.005) obniżyło jego poziom i wynosił on 66.4 pg/ml. W badanej grupie kobiet poziom FSH wynosił 6.66 pg/ml a po leczeniu utrzymywał się na podobnym poziomie i wynosił 6.12 pg/ml. Analiza wyników wykazała, iż wartości LH zarówno przed jak i po leczeniu były zbliżone do analogicznych w odniesieniu do FSH, zachowując proporcjonalność 1:1 a stwierdzone różnice nie były istotne statystycznie (p>0.05). Poziom prolaktyny (PRL) u pacjentek tej
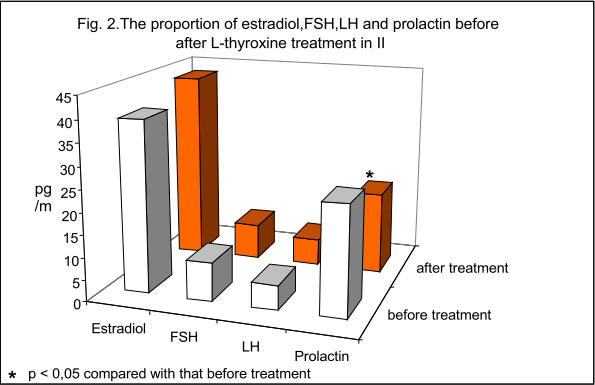
grupy, zarówno przed jak i po leczeniu był istotnie statystycznie wyższy (p<0.005) w stosunku do analogicznych wartości kobiet stanowiących grupę II-gą. U pacjentek grupy I-szej średnia wartość poziomu prolaktyny wynosiła 35.48 pg/ml. Po podaniu l-tyroksyny uległa statystycznie znamiennemu obniżeniu i wynosiła 25.05 pg/ml (p<0.005) utrzymując się
na podobnym poziomie jak u pacjentek grupy II-giej zarówno przed jak i po podaniu l-tyroksyny.
Grupa II:
Średnie wartości estradiolu w tej grupie pacjentek zarówno przed jak i po podaniu L-tyroksyny kształtowały się na podobnym poziomie i wynosiły odpowiednio: 38.96 pg/ml oraz 42.95 pg/ml (p>0.05) nie wykazując istotnych statystycznie różnic (p>0.05). W tej grupie pacjentek wartość FSH była znamiennie statystycznie wyższa (p<0.005) do analogicznej u pacjentek grupy I-szej i kształtowała się na poziomie 8.78 pg/ml i utrzymywała się na podobnym poziomie po podaniu L-tyroksyny, który wynosił 8.2 pg/ml. Analiza wyników wykazała, iż podawanie L-tyroksyny nie wpływało także na zmianę poziomów LH, które u pacjentek tej grupy przed podaniem L-tyroksyny wynosiło 5.92 pg/ml natomiast po podaniu 6.06 pg/ml. Analogicznie jak w grupie I-szej stosunek analizowanych wartości FSH jak i LH w tej grupie pacjentek kształtował się jak 1:1. W tej grupie kobiet poziom prolaktyny przed podaniem L-tyroksyny był statystycznie niższy (p<0.005) w stosunku do analogicznej wartości grupy I-szej i wynosił 24.80 pg/ml. Po podaniu L-tyroksyny podobnie jak w przypadku grupy I-szej, poziom tego hormonu uległ znamiennie statystycznemu obniżeniu do 18.51 pg/ml (p<0.005).
Dyskusja
Klinicznie wiadomo, że u kobiet cierpiących na zaburzenia tarczycy występują częste zaburzenia miesiączkowe, obniżona płodność i niepowodzenia ciąży (3,4,5). Przeprowadzone na zwierzętach badania, wykazały, iż hypotyreoza może prowadzić do zaburzeń zarówno rozwoju jak i aktywności pęcherzyków (6,7,8). W obecnej pracy postanowiono przeprowadzić analizę korelacji pomiędzy funkcją tarczycy a procesem rekrutacji pęcherzyków w jajniku u kobiet przygotowywanych do stymulacji gonadotropinowej. Niedobór hormonów tarczycowych wzmaga aktywność jajników manifestując się hyperestrogenizmem, co prowadzi do nadmiernych krwawień miesiączkowych oraz nasilonego zespołu napięcia przedmiesiączkowego. Klinicznie niedoczynność tarczycy rozpoznaje się na podstawie zarówno charakterystycznych objawów jak i odpowiednich poziomów TSH oraz T3 i T4 (9). W piśmiennictwie wiele kontrowersji wywołuje ocena stanu eutyreozy w oparciu o badania hormonalne u pacjentek z klinicznymi objawami hypotyreozy (10). Cechy kliniczne takie jak np. suchość skóry, apatia, zimno, wypadanie włosów, depresja, zmęczenie, trudności ze wstawaniem, i obrzęki na twarzy, są z jednej strony subiektywne a z drugiej mogą sugerować wiele innych przyczyn zarówno somatycznych jak i psychicznych. Randomizowane próby z zastosowaniem placebo nie przyniosły rozstrzygających rezultatów z uwagi na brak obiektywnych i powtarzalnych wskaźników skojarzonych ze stanem niedoboru hormonów tarczycowych. Nadal, zatem istnieje problem odpowiedzi na pytanie czy jest możliwy kliniczny stan hypotyreozy w obecności prawidłowych poziomów hormonów tarczycy.
McDermott i Ridgway (1) wykazali, że u pacjentek z eutyreozą na podstawie TSH wystepowanie 12,1 wyszczególnionych objawów niedoczynności tarczycy a pacjentki z łagodną niedomogą tarczycy prezentowały średnio 13,7 objawów niedoczynności tarczycy, co sugeruje efekt sumowania między poziomami hormonów tarczycy a objawami.
Subkliniczna niedoczynność tarczycy obejmowała pacjentki z prawidłowym T4 i TSH ale ze wzmożoną odpowiedzią na TRH. Watt i wsp. (11), zaobserwowali u tych pacjentek nieprawidłowa funkcję jajników w oparciu o test rezerwy jajników. Wyniki obecnej pracy wykazały, iż na podstawie diagnostycznej karty tarczycowej (Tab. I) pacjentki przedstawiały typowe objawy niedoczynności tarczycy i prawidłowe poziomy FT3 i FT4. Przeprowadzona analiza poziomów hormonów obrazujących stan czynnościowy jajników wykazała, iż podanie małych dawek terapeutycznych L-tyroksyny doprowadziło do znamiennie istotnego obniżenia prolaktyny u pacjentek obu grup oraz estradiolu tylko u kobiet stanowiących grupę I-szą (p<0.005). Uzyskanym wynikom towarzyszyła ogólna poprawa stanu klinicznego pacjentek oraz wyraźne zmniejszenie objawów hyperestrogenizmu. Obserwowany wysoki poziom estradiolu u pacjentek grupy I-szej sugeruje, analogicznie jak w przebiegu klasycznej niedoczynności tarczycy wzmożenie procesu rekrutacji i wzrost liczby pęcherzyków antralnych. Zeleznik i wsp. (12) sugerował, że rekrutacja zdefiniowana poprzez rozwój wczesnych antralnych pęcherzyków z puli zarodkowych pęcherzyków nie jest ograniczona do żadnego stadium cyklu miesiączkowego, ale postępuje niepowstrzymanie przez całe życie aż zasób pęcherzyków zarodkowych jest wykorzystany i nadchodzi menopauza. W czasie normalnego cyklu miesiączkowego pojawia się kohorta wzrastających pęcherzyków i po selekcji dominujący pęcherzyk zmierza do owulacji. Selekcja pęcherzyka dominującego ma miejsce około 5-go dnia cyklu. Następowy wzrost pęcherzyka prowadzi do wzrostu estradiolu w surowicy i inhibiny, które powodują obniżenie poziomu FSH. Aktywność pęcherzyków rekrutujących się na początku cyklu miesiączkowego obrazuje łącznie poziom estradiolu w teście rezerwy i FSH. Zależności między hormonami tarczycy a działaniem estrogenów została udokumentowana w odniesieniu do wielu fizjologicznych czynności. Oba hormony stymulują trankrypcję docelowych genów poprzez przyłączenie do swoich jądrowych receptorów, które oddziałują ze specyficznymi elementami odpowiedzi w regionie regulacyjnym genu. Fujimoto i wsp. (13) wykazali, że 1-3,5,3’-triiodothyronina (T3) wywołuje ekspresję mRNA receptora estrogenowego alpha i co sugeruje hipotezę, że odpowiedź na poziomie receptora estrogenowego jest wzmacniana poprzez T3. Wcześniejsze badania wykazały, iż androgeny intensyfikują proces rekrutacji w jajniku (14,15).
Parametr oceny rezerwy jajnikowej stanowi nie tylko wiek pacjentek, lecz także podstawowe poziomy FSH w 3-cim dniu cyklu, estradiolu, wskaźnik FSH:LH oraz inhibiny B. Niedokładność testu rezerwy, przeto może wynikać ze zmiennej w danym cyklu miesiączkowym ilości samych pęcherzyków jak i trudności w ocenie ogólnoustrojowej gospodarki hormonalnej. Utrzymująca się nadmiernie wzmożona rekrutacja pęcherzyków może jednocześnie prowadzić do wyczerpywania się ich puli tj. stopniowego zmniejszania się rezerwy jajników. Konsekwencją takiego stanu jest obserwowany w niniejszej pracy znamienny wzrost poziomu FSH w II-giej grupie pacjentek, u których średnia wartość estradiolu utrzymywała się na prawidłowym poziomie. Około 3 miesiące przed owulacja około 300 pęcherzyków jest rekrutowane do wzrostu i rozwoju. Ten wstępny wzrost pęcherzyków i wczesna replikacja komórek ziarnistych zachodzi niezależnie od hormonów gonadotropowych. Gonadotropiny przeto, startują tylko po osiągnięciu przez pęcherzyki stadium antralnego (16). Jednocześnie u pacjentek grupy II –giej, u których stężenie estradiolu kształtowało się na normalnym poziomie, podanie L-tyroksyny istotnie znamiennie obniżyło jedynie poziom prolaktyny a wartości pozostałych hormonów nie uległy zmianom. Maruo i wsp. (7) sugerowali, że hormony tarczycy współdziałają z FSH dla wywarcia bezpośredniego stymulującego wpływu na funkcje komórek ziarnistych obejmującego morfologiczne różnicowanie, tworzenie receptora LH/HCG i indukcję enzymów sterydogenzezy (3 beta- dehydrogenazy hydroxysteroidowej i aromatazy). Podwyższony w II-giej grupie pacjentek poziom FSH w stosunku do analogicznego w I-szej grupie i nieulegający zmianie po podaniu L-tyroksyny może wskazywać na długotrwały proces zmniejszania się rezerwy jajników wywołany dysfunkcją osi podwzgórze-przysadka-tarczyca. Wg Howe i wsp (17) hormony przysadki takie jak, prolaktyna hormon wzrostu TSH pośrednio i bezpośrednio mogą działać synergistycznie z LH i FSH dla wzmocnienia wejścia spoczynkowych pęcherzyków w fazę wzrostu. Armada-Dias i wsp.(4) sugerowali, że morfologiczne zmiany powodowane przez niedoczynność tarczycy mogą być skutkiem wyższej produkcji prolaktyny, która może hamować wydzielanie i działanie gonadotropin będąc główną przyczyną obserwowanych zmian. Sugestie te może potwierdzać obserwowany u pacjentek obu grup znamiennie statystyczny spadek stężenia prolaktyny.
W oparciu o uzyskane w niniejszej pracy wyniki można sugerować, iż poprzez obniżenie poziomu estradiolu u pacjentek stanowiących I-szą grupę, oraz uzyskanie spadku prolaktyny u kobiet obu grup poprzez podanie małych dawek l-tyroksyny uzyskuje się poprawę funkcji tarczycy w kierunku sterowania procesem rekrutacji pęcherzyków jajnikowych. Uzyskane wyniki wykazały, iż w stanach dysfunkcji tarczycy TRH może stymulować wydzielanie prolaktyny a korekcja tego stanu pozwala na powrót prolaktyny do prawidłowego poziomu. Analiza uzyskanych wyników pozwala na postawienie hipotezy, iż głównym i obiektywnym parametrem sugerującym zaburzenia wydzielania hormonów tarczycowych u młodych kobiet, może być podwyższony poziom estradiolu na początku cyklu menstruacyjnego. W wielu pracach dyskutowany jest problem klinicznego stanu hypotyreozy w obecności prawidłowych poziomów hormonów tarczycowych a wyjaśnienie tego zjawiska nadal pozostaje nierozstrzygnięte(18,19). Thomas i Reid (20) sugerowali, że czynność tarczycy i prolaktyny są ściśle ze sobą powiązane. Zwiększona produkcja TRH lub bardziej prawdopodobne, zmniejszony podwzgórzowy obrót dopaminy mógłby być odpowiadać za hypersekrecję TSH i prolaktyny w niedoczynności tarczycy. U ludzi, uwalnianie TSH po TRH jest wzmożone przez leczenie estradiolem, ponieważ być może estrogeny zwiększają liczbę receptorów TRH (21).
Stwierdzono ponadto istnienie rytmu wydzielania TSH i TRH której mechanizm mógłby być odpowiedzialny za okołodobowe zmiany wydzielania hormonów tarczycy, oparte na układzie sprzężenia zwrotnego (22).
TSH rozpoczyna wzrastać kilka godzin przed początkiem snu, osiągając maksymalne poziomy między 23 a 4 godziną w nocy i spadają stopniowo do minimum o 11.00 Istnieje hipoteza iż maksymalny wyrzut TSH w ciemnej fazie cyklu dobowego utrzymuje adekwatny poziom tego hormonu w fazie jasnej (23,24,25)). Jednocześnie Nimalasurija iwsp.(26) doszli do wniosku że dobowy rytm w surowicy T3 nie jest zależny od TSH a raczej jest pod wpływem pewnych niezidentyfikowanych sygnałów w diecie, które zmieniają wydajność obwodowej konwersji T4 do T3. Można zatem spekulować, iż zaburzenia okołodobowego rytmu osi podwzgórze-przysadka-tarczyca będą modulować funkcję tarczycy.
W naszej opinii łagodna niedomoga tarczycy jest powszechnym zaburzeniem i może być skojarzona z wieloma somatycznymi objawami. Wiele z tych skutków może być skorygowane po wprowadzeniu terapii L-tyroxyną Mimo tych pozytywnych wskazań, że leczenie hormonami tarczycy przynosi korzyści jest kilka pytań bez odpowiedzi. Te wyniki sugerują, że u kobiet cierpiących z powodu zaburzeń czynności tarczycy występuje skojarzona nadmierna aktywność jajników, łagodna hyperprolaktynemia, zaburzenia miesiączkowe i obniżona płodność.
W oparciu o dane literaturowe oraz wyniki obecnej pracy można postulować konieczność dalszych badań nadających ważność testów rezerwy jajnikowej w szczególności w stosunku do pacjentek poddawanych stymulacji jajników gonadotropinami i objętych programem wspomaganego rozrodu.
Wnioski
- Ośrodkowa dysregulacja układu TRH-TSH prowadzi do rozwoju obrazu niedoczynności tarczycy.
- Podwyższony poziom estradiolu w teście rezerwy jajnika jest markerem zwiększonej rekrutacji pęcherzyków w procesie względnej niedoczynności tarczycy.
- Hyperprolaktynemia wskazuje na ośrodkowe pochodzenie dysfunkcji tarczycy.
- Małe dawki tyroksyny normalizują czynność tarczycy i jajników.
Piśmiennictwo
- Mc Dermott MT, Ridgway EC: Subclinical hypothyroidism is mild thyroid failure and should be treated.
J Clin Endocrinol Metab 2001,86:4585-4590. - Fitko R, Szlezingier B, gajewska A, Kochan C : Ovarian LH/HCG receptors and plasma level of LH, 17 beta estradiol and progesterone in gonadotropin-induced PCO syndrome in rats.
Exp Clin Endocrinol 1994, 102:320-325. - Maruo T, Hiramatsu S., Otani T., Hayashi M, Mochizuki M: Increase in the expression of thyroid hormone receptors in porcine granulose cells early in follicular maturation.
Acta Endocrinologica 1992,127:152-60. - Armada-Dias L, Carvalho JJ, Breitenbach MM, Franci CR, Moura EG: Is the infertility in hypothyroidism mainly due to ovarian or pituitary functional changes?
Braz J Med Biol Res 2001, 39(9):1209-15. - Moretti C, Toscano V: Dynamic evaluation of ovarian reserve and abnormal androgen excess in women.
J Endocrinol Invest 2003,26(7 suool):114-123. - Haraguchi K, Peng X, Kaneshige M, Anzai E, Endi T, Onaya T: Thyrotropin- dependent desensitization of Chinese hamster ovary cells that express the recombinant human thyrotropin receptor.
J Endocrinol 1993,139(3):425-29. - Maruo T, Hayashi M, Matsuo H, Yamamoto T, Okada H, Mochizuki M: The role of thyroid hormone as a biological amplifier of the actions of follicle-stimulating hormone in the functional differentiation of cultured porcine granulose cells.
Endocrinology 1987, 121:1233-1241. - Cecconi S, Rucci N, Scaldaferri ML, Masciulli MP, Rossi G, Moretti C, D’Armiento M, Ulisse S: Thyroid hormone effects on mouse oocyte maturation and granulose cell aromatase activity.
Endocrinology 1999, 140(4):1783-1788 - Redmond GP: Thyroid dysfunction and women’s reproductive health.
Thyroid 2004,14(suppl.1):5-15. - Raber W, Nowotny P, Vytiska-Binstorfer E, Vierhapper H: Thyroxine treatment Anadiol and progesterone.
Chronobiologia 1989, 16(4):353-63. - Watt AH, Legedza ATR, Ginsburg ES, Barbieri RL, Clarke RN, Hornsteuin MD: The prognostic value of age and follicle stimulating hormone levels in women over forty years of age undergoing in vitro fertilization.
J Assist Reprod Gen 2000; 15(5):264-268. - Zeleznik AJ : Dynamics of primate follicular growth. In The ovary. EY Adashi, PCK
- Fujimoto n, Jinno N, Kitamura S: Activation of estrogen response element dependent transcription by thyroid hormone with increase in estrogen receptor levels in a rat pituitary cell line, GH3.
J Endocrinology 2004, 108(1):77-83. - Vendola K, Zhou J, Wang J, Famuyiwa OA, Bievre M, Bondy CA: Androgens promote oocyte insulin-like growth factor I expression and initiation of follicle development in the primate ovary.
Biol Reprod 1999, 61(2):353-7. - Vendola KA, Zhou J, Oluyemisi OA, Wiel SJ, Bondy C: Androgens stimulate early stages of follicular growth in the primate ovary.
J Clin Invest 1998, 101(12): 2622-2629. - Lunenfeld B, Insler V: From animal gonadotrophins to recombinant FSH.
1999 eds. Action Press, Morley, Western Australia - Howe E., Lintern-Moore S., Moore GPM, Hawkins J: Ovarian development in hypopituarity snell dwarf mice. The size and composition of the follicle population.
Biol. Reproduction 1978,19:959-64. - Lum SM, Nicoloff JT, Spencer CA, Kaptein EM: peripheral tissue mechanism for maintenance of serum triiodothyronine values in a thyroxine-deficient state in man.
J Clin Invest 1094,73(2):570-5. - Kaptain EM, Grieb DA, Spencer CA, Wheeler WS, Nicoloff JT: thyroxine metabolism in the low thyroxine state of critical nonthyroidal illness.
J Clin Endocrinol Metab 1981,53:764-771. - Thomas R, Reid RL: Thyroid disease and reproductive dysfunction :a review. Obstet Gynecol 1987,70: 789-798.
- Gershengorn MC, Marcus-Samuels BE, Geras E: Estrogens increase the number of thyrotropin-releasing hormone receptors on mammotropic cells in culture.
Endocrinology 1979,105:171. - Weeke J, Gundersen HJ: Circadian and 30 minutes variations in serum TSH and thyroid hormones in normal subjects. Acta Endocrinologica
- Carandente F, Angeli A, Candiani GB, Crosignani PG, Dammacco F, DeCecco L, Marrama P, Massobrio M, Martini L :Rhythms in the ovulatory cycle. 2 nd : LH, FSH, estradiol and progesterone.
Chronobiologica 1989, 16(4):353-63. - Chan V, Jones A, Liendo-Ch P, McNeilly A, Landon J, Besser GM:The relationship between circadian variations in circulationg thyrotropin, thyroid hormones and prolactin.
Clin Endocrionol 1978,9(4):337-49. - Landyshev I, Mishchuk VP, Lysenko VA, Petrov AV: circadian rhythms of hypophysis-thyroid hormones secretion in patients with bronchial asthma.
Ter Arkh:2000, 72(3):13-15. - Nimalasuriya A, Spencer CA, Lin SC, Tse JK, Nicoloff JT: Studies on the diurnal pattern of serum 3,5,3-triiodothyronine.
J Clin Endocrinol Metab 1986, 62(1):153-8.
Ovarian reserve can be predicted by assessment of basal serum FSH and estradiol levels early in the follicular phase. An elevated FSH level on cycle day 3 ( >12 mIU/mL) is indicative of substantially poorer prognosis for hyperstimulation. FSH:LH ratio>or= 3,6 in menstrual cycle before IVF predicted a poor response to COH. Early follicular phase (day 3) estradiol levels exceeding 75 pg/mL, also connote a potential for hyperstimulation.
Purpose: To examine the impact of hypothyroid state on cycle day 3 serum FSH, LH and estradiol levels.
Methods: A group of patients were identified as hypothyroid upon a special questionare. They were divided into two groups, regarding day 3 estradiol (cut off point 75 pg/ml) and were treated 25-50 μg of levothyroxin daily. In the third menstrual period patient status an hormonal data were assessed.
Zeleznik A J: Dynamics of Primate Follicular Growth. In The Ovary Ed.Adashi E Y,Leung P
C K.Raven Press.New York 1993.


